“I veri elementi guida dell’evoluzione non sono le specie o gli organismi, ma i geni. ”
— Edoardo Boncinelli
La ricerca scientifica continua a fare progressi nella lotta contro le malattie neurologiche, e uno degli ultimi sviluppi più promettenti riguarda l’utilizzo di un parassita ingegnerizzato per trasportare proteine terapeutiche nel cervello. Questo approccio innovativo potrebbe rappresentare una svolta nella somministrazione di trattamenti efficaci per patologie come l’Alzheimer, il Parkinson e altre condizioni neurodegenerative. In questo articolo, esploreremo il potenziale rivoluzionario di questa tecnologia, la sfida superata della barriera ematoencefalica e il ruolo chiave del parassita Toxoplasma gondii come vettore promettente nel trasporto di proteine nel sistema nervoso centrale.
Un passo avanti per il trattamento delle malattie neurologiche
La ricerca scientifica nel campo delle malattie neurologiche ha fatto un importante passo avanti grazie alla recente scoperta di una tecnologia innovativa che utilizza il parassita Toxoplasma gondii come vettore per il trasporto di proteine terapeutiche nel cervello. Questo parassita, comunemente associato alla toxoplasmosi, è stato ingegnerizzato in laboratorio per essere in grado di attraversare la barriera ematoencefalica, una delle principali sfide nella somministrazione di farmaci al sistema nervoso centrale. Questo risultato apre nuove prospettive nel trattamento di malattie neurologiche come l’Alzheimer, il Parkinson e l’ictus, consentendo di consegnare direttamente le proteine terapeutiche nel cervello, dove possono agire in modo mirato e efficace. Questa tecnologia promette di rivoluzionare l’approccio terapeutico a queste patologie, aprendo la strada a nuove frontiere nella somministrazione di proteine terapeutiche nel sistema nervoso centrale.
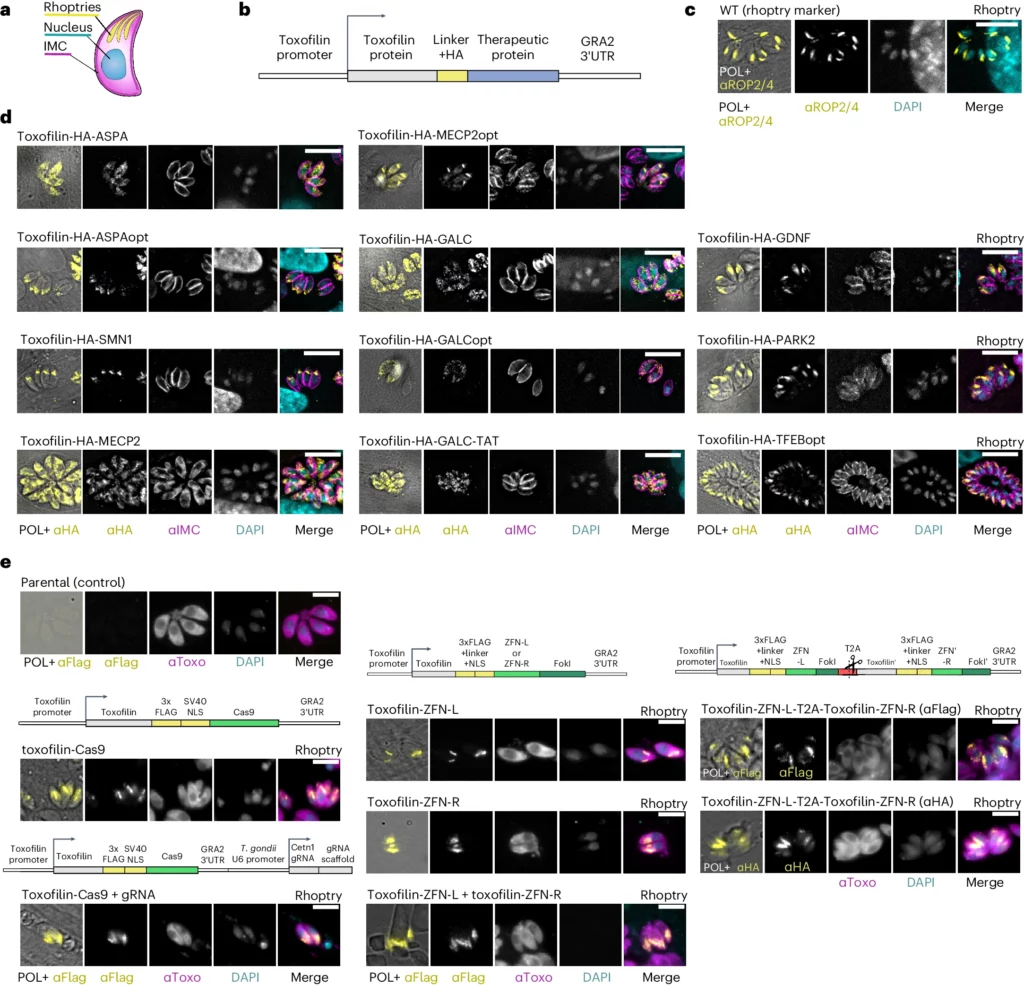
a, illustrazione di una cellula di T. gondii. IMC, complesso della membrana interna (contorno del parassita). b, Schema dei costrutti genetici utilizzati. c, T. gondii RH intracellulare immunostimolato con il marcatore di roptismo anti-ROP2/4, in cellule HFF. d, T. gondii RH intracellulare che esprime in modo stabile diverse proteine terapeutiche fuse con toxofilina associate a malattie neurologiche umane, in HFF. e, T. gondii RH intracellulare che esprime in modo stabile diverse proteine terapeutiche fuse con toxofilina, in HFF. gondii che esprime in modo stabile diverse proteine terapeutiche fuse con toxofilina e associate a malattie neurologiche umane, in cellule HFF. e, T. gondii intracellulare che esprime diverse varianti di nucleasi zinc finger fuse con toxofilina e Cas9. Lo schema di ciascun costrutto genetico è visualizzato sopra l'immagine del T. gondii che lo esprime. Le immagini mostrate sono rappresentative della localizzazione della proteina in diverse trasfezioni indipendenti. Barre di scala, 10 μm.
La barriera ematoencefalica: una sfida superata
La barriera ematoencefalica (BBB) è una sfida significativa nel trattamento delle malattie neurologiche, poiché impedisce alle sostanze terapeutiche di raggiungere il cervello. Tuttavia, recenti sviluppi nella tecnologia del parassita ingegnerizzato hanno aperto nuove prospettive per superare questa barriera. Il Toxoplasma gondii, un parassita che infetta i roditori e può attraversare la BBB, è stato modificato geneticamente per trasportare proteine terapeutiche nel sistema nervoso centrale. Questo approccio offre un potenziale rivoluzionario nel trattamento di malattie come l’Alzheimer e il Parkinson, consentendo alle proteine terapeutiche di raggiungere direttamente le aree cerebrali colpite. La capacità del Toxoplasma gondii di attraversare la BBB in modo sicuro ed efficiente rappresenta un importante passo avanti nella somministrazione di farmaci nel cervello e potrebbe aprire la strada a nuove frontiere nel campo delle terapie neurologiche.
Il potenziale rivoluzionario della tecnologia del parassita ingegnerizzato
Il potenziale rivoluzionario della tecnologia del parassita ingegnerizzato risiede nella sua capacità di trasportare proteine terapeutiche nel cervello. Questo approccio innovativo si basa sull’utilizzo del Toxoplasma gondii, un parassita che è stato modificato geneticamente per diventare un vettore efficace nel sistema nervoso centrale. Grazie alla sua capacità di attraversare la barriera ematoencefalica, il parassita ingegnerizzato può raggiungere specificamente le regioni cerebrali colpite da malattie neurologiche, offrendo un metodo di somministrazione diretta e mirata di proteine terapeutiche. Questo rappresenta un notevole progresso nel trattamento delle malattie neurologiche, poiché consente di superare le sfide legate alla consegna di farmaci al cervello. Sebbene questa tecnologia sia ancora in fase di sviluppo, le sue potenzialità sono promettenti e potrebbero aprire nuove frontiere nella terapia delle patologie del sistema nervoso centrale.
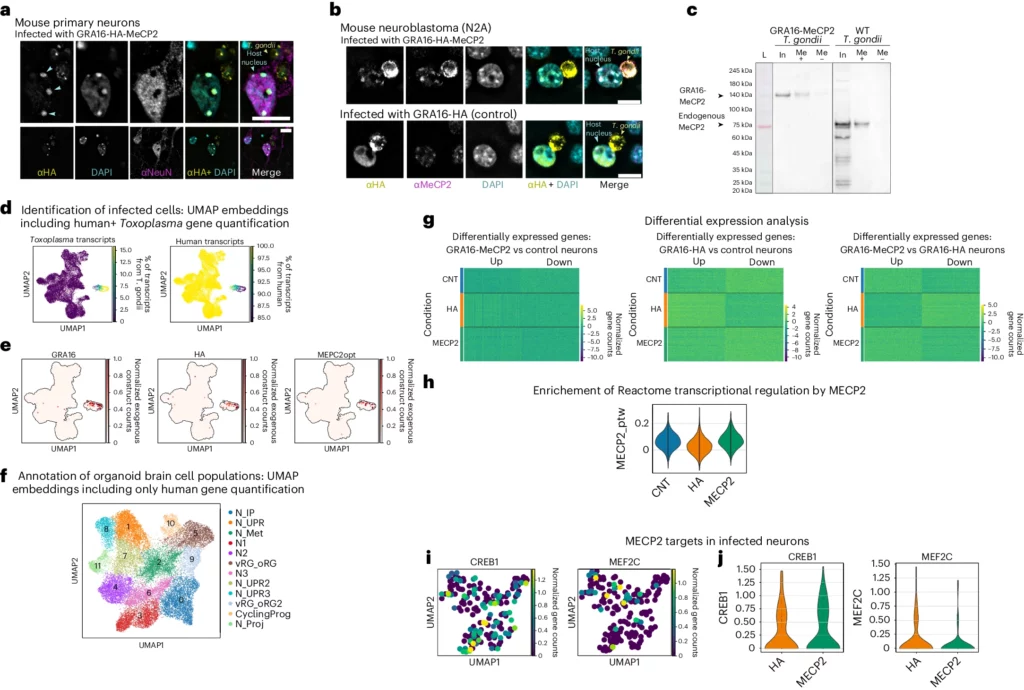
a, Neuroni primari di topo inoculati con GRA16-MeCP2. Le immagini in alto mostrano una vista ravvicinata del soma e di T. gondii (2 ripetizioni indipendenti). Le punte di freccia blu indicano la co-localizzazione di GRA16-MeCP2 con foci di DNA eterocromatico. Barre di scala, 10 μm. b, cellule di neuroblastoma di topo inoculate con GRA16-MeCP2 e GRA16-HA T. gondii (2 ripetizioni indipendenti). Barre di scala, 10 μm. c, test di pull-down di lisati proteici di cellule HFF infettate con GRA16-MeCP2 o WT ME49 T. gondii. L, ladder proteico; In, lisato di input; Me(+), pull down proteico con sonde di DNA metilato; Me(-), pull down proteico con sonde di DNA non metilato; anticorpo primario, anti-MeCP2. Blot rappresentativo di 3 ripetizioni indipendenti. d, UMAP di singole cellule basata sulla quantificazione dei geni umani+T. gondii, colorata in base alla percentuale di trascritti di Toxoplasma e umani. e, stessa UMAP di d ma colorata in base alla conta dei trascritti dei costrutti esogeni. f, UMAP di singole cellule basata sull'espressione dei geni umani. I cluster principali sono stati identificati e colorati in base ai sottotipi cellulari. CyclingProg, progenitori ciclici; vRG_oRG, vRG_oRG2, glia ventricolare e radiale esterna; N_IP, progenitori neuronali intermedi; N1, N2, N3, cluster neuronali; N_UPR, N_UPR2, N_UPR3, neuroni con firma di unfolded protein response; N_Met, neuroni con firma di regolazione metabolica; N_Proj, neuroni con firma di regolazione assonale. g, mappa di calore che mostra la distribuzione dei geni differenzialmente espressi tra i neuroni degli organoidi infettati con GRA16-MeCP2 vs. non infetti (sinistra), GRA16-HA vs. non infetti (centro) e GRA16-MeCP2 vs. GRA16-HA (destra). h, Violin plot che mostra l'espressione media dei geni appartenenti al pathway “Reactome transcriptional regulation by MECP2”; arricchimento norm. = 3,19, P = 0,001417 per il confronto GRA16-MeCP2 vs GRA16-HA. i, UMAP di singoli neuroni infettati colorati in base all'espressione di CREB1 e MEF2C. j, Violin plot che mostra la distribuzione dei conteggi di CREB1 e MEF2C tra i neuroni degli organoidi infettati con GRA16-HA e GRA16-MeCP2. Tutti i dati scRNA-seq includono 3 repliche biologiche (sospensioni di singole cellule dissociate da 3 organoidi diversi) per ciascuna condizione.
Verso una nuova frontiera nella somministrazione di proteine terapeutiche
La somministrazione di proteine terapeutiche nel sistema nervoso centrale è un campo in continua evoluzione, e la tecnologia del parassita ingegnerizzato potrebbe rappresentare una nuova frontiera in questo ambito. Utilizzando Toxoplasma gondii come vettore, i ricercatori sono stati in grado di trasportare proteine terapeutiche direttamente nel cervello. Questo approccio innovativo supera le sfide legate alla barriera ematoencefalica, che normalmente impedisce il passaggio di molecole terapeutiche nel cervello. Il parassita ingegnerizzato può attraversare questa barriera in modo sicuro ed efficiente, aprendo nuove possibilità per il trattamento di malattie neurologiche come l’Alzheimer, il Parkinson e gli ictus. Questa tecnologia offre un metodo promettente per fornire proteine terapeutiche direttamente ai tessuti cerebrali interessati, consentendo una maggiore precisione e efficacia nel trattamento delle malattie neurologiche. Il futuro della somministrazione di proteine terapeutiche nel cervello sembra quindi molto promettente grazie a questa nuova frontiera della tecnologia del parassita ingegnerizzato.
Toxoplasma Gondii: un vettore promettente per il trasporto di proteine nel sistema nervoso centrale
Toxoplasma Gondii, un parassita che comunemente infetta mammiferi e uccelli, potrebbe rivelarsi un vettore promettente per il trasporto di proteine nel sistema nervoso centrale. I ricercatori hanno scoperto che questo parassita può attraversare la barriera ematoencefalica, una barriera protettiva che normalmente impedisce alle sostanze nocive di entrare nel cervello. Utilizzando tecniche di ingegneria genetica, i ricercatori sono stati in grado di modificare il parassita per produrre e trasportare proteine terapeutiche direttamente nel cervello. Questa scoperta apre nuove prospettive per il trattamento delle malattie neurologiche, consentendo l’accesso mirato alle regioni cerebrali colpite da queste patologie. Sfruttare Toxoplasma Gondii come vettore per il trasporto di proteine terapeutiche potrebbe rappresentare una svolta nella somministrazione di farmaci nel sistema nervoso centrale, offrendo nuove speranze per pazienti affetti da disturbi neurologici.
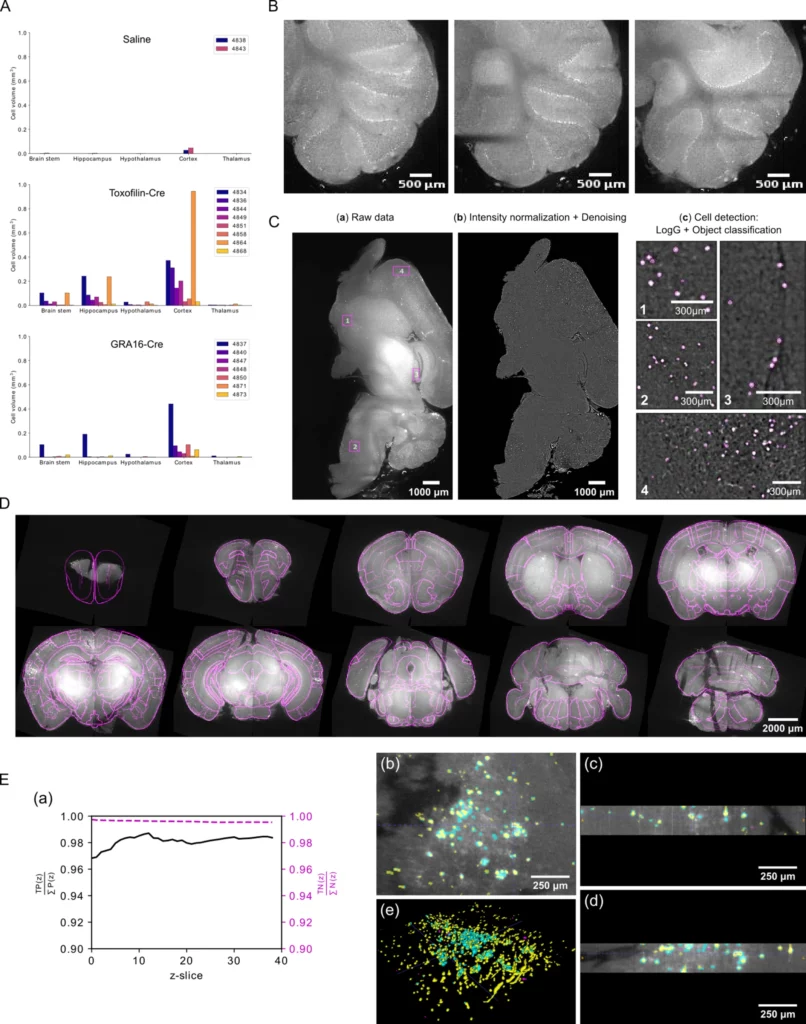
(A) Distribuzione del trasporto di proteine mediato da granuli densi e da rofotteri da parte di Pru T. gondii in diverse regioni cerebrali, volume cellulare per regione cerebrale, per animale in ciascun gruppo (i numeri identificativi dei topi sono indicati nella legenda). (B) Immagini grezze dell'autofluorescenza dei neuroni di Purkinje nel cervelletto di topi di controllo iniettati con soluzione salina. Le fette rappresentate sono tratte dal campione 4843. Il numero di campioni biologicamente indipendenti nel gruppo salino è N = 2. (C) Risultati rappresentativi della pipeline di rilevamento delle cellule 3D nel cervello intero. Tutte le operazioni sono tridimensionali, ma per semplicità mostriamo l'output solo su una fetta del campione 4864. (a) Dati grezzi. (b) Ripristino dell'immagine dopo la normalizzazione dell'intensità e il denoising. (c) Sovrapposizione del perimetro delle cellule rilevate (bordo magenta) e dei dati grezzi. I numeri da 1 a 4 corrispondono alle quattro caselle mostrate in (a). (D) Risultato rappresentativo dell'allineamento all'Atlante cerebrale di Allen. Vista coronale dei dati grezzi allineati (scala di grigi), sull'Atlante (linee di contorno magenta). I riquadri corrispondono a fette della vista coronale a diverse profondità del campione. L'output corrisponde al campione 4864. (E) Convalida della segmentazione rispetto alle annotazioni manuali di esperti del dominio. (a) Convergenza dei pixel veri positivi (TP) e veri negativi (TN), rispetto al numero di fette z incluse nel calcolo. (b,c,d) Sovrapposizione di segmentazioni e dati grezzi, mostrati in fette lungo i piani (b) xy, (c) yz e (d) xz. Codice colore: giallo: nucleo cellulare correttamente rilevato, ciano: regione di confine non rilevata intorno ai nuclei cellulari, magenta: falsi negativi. (e) Vista 3D dei dati segmentati e colorati come descritto sopra. Le immagini (b)-(e) sono state realizzate con il software ITK-SNAP (Yushkevich et al 2006).
Bracha, S., Johnson, H.J., Pranckevicius, N.A. et al. Engineering Toxoplasma gondii secretion systems for intracellular delivery of multiple large therapeutic proteins to neurons. Nat Microbiol (2024). https://doi.org/10.1038/s41564-024-01750-6
In conclusione…
Il parassita Toxoplasma gondii rappresenta un vettore promettente per il trasporto di proteine terapeutiche nel sistema nervoso centrale, aprendo nuove prospettive per il trattamento delle malattie neurologiche. Grazie alla sua capacità di attraversare la barriera ematoencefalica e raggiungere le regioni cerebrali, questo parassita ingegnerizzato potrebbe rivoluzionare la somministrazione di farmaci nel cervello. Questa tecnologia offre una nuova frontiera nella lotta contro patologie come l’Alzheimer, il Parkinson e altre malattie neurodegenerative, offrendo la possibilità di fornire direttamente al cervello le proteine necessarie per il loro trattamento. Tuttavia, mentre i risultati finora ottenuti sono promettenti, è fondamentale approfondire gli studi per comprendere appieno gli effetti a lungo termine di questa tecnologia e garantirne la sicurezza e l’efficacia. Solo attraverso ulteriori ricerche e sperimentazioni potremo scoprire fino a che punto questo parassita ingegnerizzato potrà essere utilizzato nella pratica clinica, aprendo così nuovi orizzonti nella cura delle malattie neurologiche.





