“Non credo alla predestinazione. Esiste soltanto la predisposizione. Vi sono persone predisposte a morire di cancro e altre predisposte a morire impiccate, con lo stesso rigore clinico.”
— Ennio Flaiano
Le alterazioni epigenetiche rappresentano una nuova prospettiva nella ricerca sui tumori, offrendo un’inaspettata chiave per comprendere le dinamiche di sviluppo e progressione delle neoplasie. Recentemente, una scoperta rivoluzionaria ha svelato il ruolo fondamentale delle mutazioni genetiche nei tumori, aprendo la strada a nuove strategie terapeutiche. Uno studio sul moscerino della frutta ha fornito un paradigma del tumore senza mutazioni, evidenziando l’intreccio complesso tra i meccanismi genetici ed epigenetici nella tumorigenesi. Inoltre, la deplezione transitoria delle proteine polycomb si è rivelata una svolta significativa nella ricerca sul cancro. Questo articolo esplorerà in dettaglio queste tematiche, analizzando come le alterazioni epigenetiche stiano cambiando radicalmente il nostro approccio alla comprensione e alla cura dei tumori.
Le alterazioni epigenetiche: un’inaspettata chiave per comprendere i tumori
Le alterazioni epigenetiche rappresentano un aspetto inaspettato ma cruciale per comprendere l’origine e lo sviluppo dei tumori. Queste modificazioni, che coinvolgono la regolazione dell’espressione genica senza modificare la sequenza del DNA, possono influenzare il comportamento delle cellule tumorali e favorire la loro crescita incontrollata. La ricerca ha dimostrato che le alterazioni epigenetiche sono coinvolte in numerosi processi chiave della tumorigenesi, come la disattivazione di geni soppressori dei tumori e l’attivazione di oncogeni. Inoltre, si è scoperto che queste modificazioni possono essere ereditate dalle cellule figlie durante la divisione cellulare, contribuendo alla stabilità delle alterazioni genetiche e all’evoluzione del tumore nel tempo. Comprendere il ruolo delle alterazioni epigenetiche nella formazione dei tumori potrebbe aprire nuove prospettive nella diagnosi e nel trattamento del cancro, aprendo la strada a terapie mirate che agiscono sulla regolazione epigenetica delle cellule tumorali.
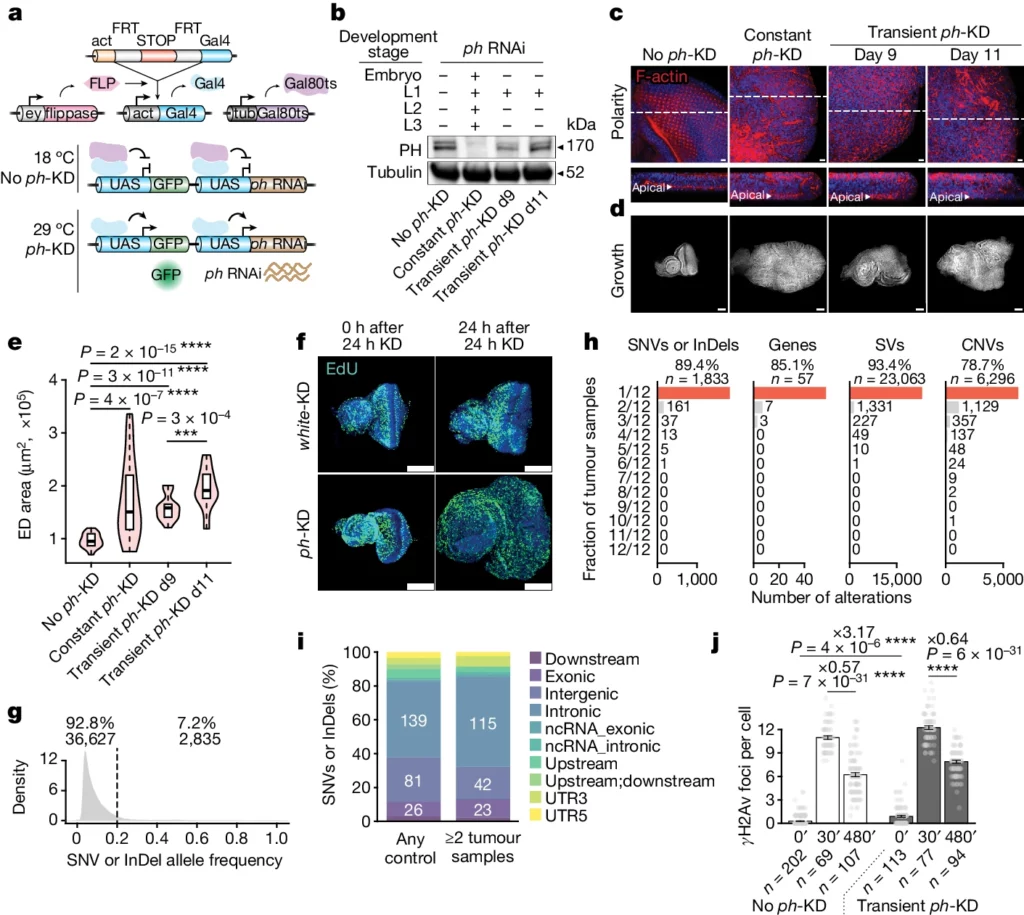
a, schema del sistema ph-KD condizionale (Metodi). b, analisi Western blot delle concentrazioni di proteine PH negli ED di larve L3 sottoposte a ph-KD assente (controllo), costante o transitoria allo stadio L1. c, immagini confocali rappresentative della colorazione della F-actina (rosso) che mostrano un epitelio polarizzato con F-actina apicale (sezioni trasversali xz in basso) in assenza di ph-KD (controllo, a sinistra), mentre la polarità è interrotta nelle ED sottoposte a ph-KD costante o transitoria (sezionate allo stadio L3). Il DNA è colorato con DAPI (blu). d,e, la colorazione DAPI (d) è usata per misurare le aree delle ED (e) in assenza di ph-KD (controllo), in condizioni di ph-KD costante o transiente (n = 30 ED per condizione; test di Wilcoxon a due facce: ***P < 1 × 10-3, ****P < 1 × 10-5; i riquadri mostrano la mediana (linea), i quartili superiore e inferiore (riquadro) ±1,5× intervallo interquartile (baffi); gli outlier non sono mostrati). f, colorazione EdU (verde) ripresa a 0 h (sinistra) e 24 h (destra) dopo 24 h di w-KD (controllo, in alto) o ph-KD (in basso). g, distribuzione delle frequenze di SNV somatici o alleli InDel rilevati in tutti i campioni. h, Numero di campioni tumorali in cui sono stati trovati SNV o InDel, geni con SNV o InDel deleteri, varianti strutturali (SV) e CNV. i, Distribuzione caratteristica di SNV o InDel trovati in uno qualsiasi dei campioni di controllo (senza ph-KD, barra di sinistra) o condivisi tra almeno due campioni tumorali (barra di destra). j, Numero di foci γH2Av per cellula prima (0 min; indicato come 0′) e dopo (30 e 480 min, indicati come 30′ e 480′) l’esposizione all’irradiazione di 5 Gy in ED di controllo (senza ph-KD, a sinistra) o ph-KD transitorio (a destra). I singoli punti di dati sono indicati in grigio e le barre corrispondono alla media ± all’errore standard (baffi). Test t a due facce ****P < 1 × 10-5. Barre di scala, 10 μm (c), 100 μm (d,f).
La scoperta rivoluzionaria sul ruolo delle mutazioni genetiche nei tumori
La comprensione del ruolo delle mutazioni genetiche nella formazione dei tumori ha subito una svolta rivoluzionaria grazie a una recente scoperta scientifica. Gli scienziati hanno identificato un legame diretto tra le mutazioni genetiche e l’insorgenza di vari tipi di tumori. Questa scoperta ha aperto nuove prospettive nella ricerca sulla comprensione dei meccanismi alla base della tumorigenesi. Le mutazioni genetiche possono alterare il funzionamento normale delle cellule, causando la proliferazione incontrollata e la formazione di tumori. Questa scoperta è stata fondamentale per lo sviluppo di nuove terapie mirate che puntano a correggere specifiche mutazioni genetiche responsabili dello sviluppo del cancro. Inoltre, ha fornito importanti informazioni sulle cause dei tumori e potrebbe contribuire allo sviluppo di strategie preventive più efficaci. La comprensione del ruolo delle mutazioni genetiche nei tumori è un passo avanti significativo nella lotta contro questa malattia devastante.
Studio sul moscerino della frutta: il paradigma del tumore senza mutazioni
Lo studio sul moscerino della frutta rappresenta un paradigma affascinante nella ricerca sul tumore senza mutazioni. Questo insetto è stato utilizzato come modello di studio per comprendere meglio il meccanismo di formazione dei tumori che non sono causati da mutazioni genetiche. I ricercatori hanno scoperto che, nonostante la mancanza di mutazioni, il moscerino della frutta può sviluppare tumori attraverso alterazioni epigenetiche. Le modificazioni nell’espressione dei geni possono essere ereditate da una generazione all’altra e possono portare alla formazione di tumori senza la presenza di mutazioni genetiche evidenti. Questa scoperta ha aperto nuove prospettive nella comprensione dei meccanismi sottostanti alla tumorigenesi e ha evidenziato l’importanza delle alterazioni epigenetiche nel processo di sviluppo del cancro. L’utilizzo di modelli animali come il moscerino della frutta può fornire informazioni preziose sulla complessità del cancro e sulla sua origine, anche in assenza di mutazioni genetiche rilevanti.
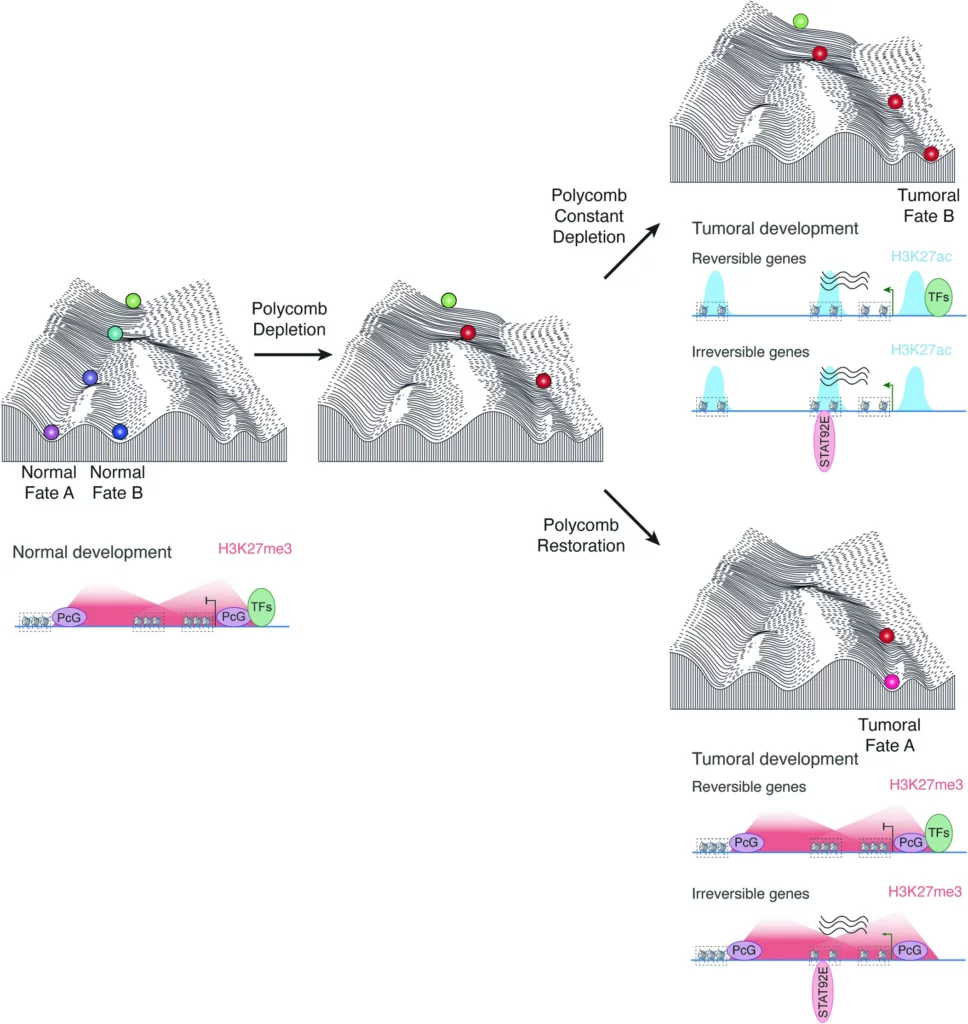
Il modello si basa sul noto paesaggio di Waddington che raffigura una biglia che rotola lungo un pendio con scelte multiple di traiettorie che dipendono dalle colline e dalle valli incontrate sul loro percorso. Questo schema è una metafora dei molteplici possibili destini cellulari che possono derivare da una singola cellula che rappresenta lo zigote ed è spesso usato per indicare che l’eredità epigenetica contribuisce alla trasmissione stabile dei destini cellulari, una volta determinati da segnali intrinseci ed estrinseci.
L’intreccio genetico ed epigenetico nella tumorigenesi
L’intreccio genetico ed epigenetico nella tumorigenesi è un tema affascinante che ha catturato l’attenzione degli scienziati negli ultimi anni. La comprensione di come le alterazioni genetiche e le modificazioni epigenetiche interagiscano nel processo di sviluppo dei tumori è fondamentale per identificare nuove strategie terapeutiche. Le mutazioni genetiche possono causare cambiamenti nella sequenza del DNA, ma non spiegano completamente la complessità dei tumori. Le modificazioni epigenetiche, invece, influenzano l’espressione genica senza alterare la sequenza del DNA e possono essere responsabili di alterazioni nel comportamento delle cellule tumorali. L’intreccio tra queste due componenti svolge un ruolo cruciale nella tumorigenesi, poiché le alterazioni genetiche possono influenzare le modificazioni epigenetiche e viceversa. Comprendere come queste interazioni avvengono può aprire nuove strade nella ricerca sul cancro e nella scoperta di nuovi bersagli terapeutici.
La deplezione transitoria delle proteine polycomb: una svolta nella ricerca sul cancro
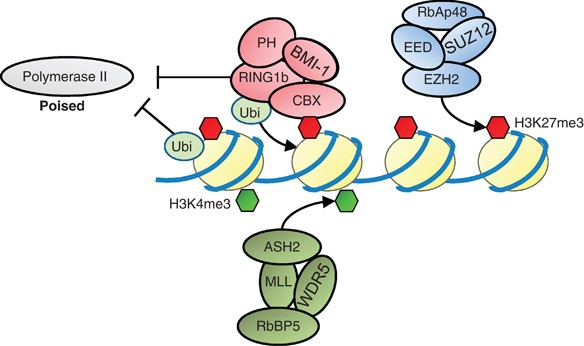
La deplezione transitoria delle proteine polycomb è emersa come una svolta promettente nella ricerca sul cancro. Le proteine polycomb sono coinvolte nel regolare l’espressione genica, e alterazioni nella loro funzione sono state associate allo sviluppo di tumori. Tuttavia, uno studio recente ha dimostrato che la deplezione temporanea delle proteine polycomb può effettivamente sopprimere la crescita tumorale. Utilizzando il moscerino della frutta come modello, i ricercatori hanno dimostrato che la deplezione transitoria delle proteine polycomb inibisce la formazione di tumori anche in assenza di mutazioni genetiche. Questa scoperta suggerisce che le alterazioni epigenetiche, come la modulazione dell’espressione genica attraverso le proteine polycomb, possono svolgere un ruolo cruciale nella tumorigenesi. Questo nuovo approccio potrebbe aprire nuove strade per lo sviluppo di terapie innovative per il trattamento del cancro basate sulla regolazione epigenetica.
Parreno, V., Loubiere, V., Schuettengruber, B. et al. Transient loss of Polycomb components induces an epigenetic cancer fate. Nature (2024). https://doi.org/10.1038/s41586-024-07328-w
In conclusione…
In questo articolo abbiamo esplorato il ruolo delle alterazioni epigenetiche nella ricerca sui tumori, riconoscendo la loro importanza nel comprendere meglio la tumorigenesi. La scoperta rivoluzionaria sul ruolo delle mutazioni genetiche nei tumori ha aperto nuove prospettive nella ricerca, ma lo studio sul moscerino della frutta ha dimostrato che i tumori possono svilupparsi anche in assenza di mutazioni genetiche evidenti. L’intreccio complesso tra genetica ed epigenetica nella tumorigenesi richiede ulteriori approfondimenti per svelare i meccanismi sottostanti. La deplezione transitoria delle proteine polycomb ha mostrato risultati promettenti nella ricerca sul cancro, aprendo nuove possibilità terapeutiche. Queste scoperte sollevano domande importanti sulle cause dei tumori e sulla loro potenziale cura. Cosa ci riserverà il futuro nella comprensione delle alterazioni epigenetiche e nel loro impatto sui tumori?